Chloralhydrat aus Ethanol und Chlor [302-17-0-A] C2H3Cl3O2
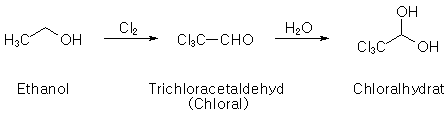
Ausführung im Abzug. In einen 250-ml-Dreihalskolben gibt man 87.5 ml
(1.5 mol) 99%iges Ethanol. Der Kolben wird samt Inhalt gewogen, mit
Gaseinleitungsrohr, Schliffstopfen und Rückflusskühler mit
Gasableitungsrohr versehen und über eine Sicherheitsflasche und eine
Waschflasche nach Muencke, die etwa 40 ml Schwefelsäure enthält, mit
der Chlorquelle (Chlorbombe) verbunden.
Zunächst leitet man unter Eiskühlung einen nicht zu starken Chlor-Strom
(≈ 5 Blasen/sec) ein. Nach etwa 45 Minuten wird die Temperatur des
Wasserbades innerhalb von 30 Minuten auf Siedetemperatur gebracht und
dann so lange Chlor in der Siedehitze eingeleitet, bis insgesamt 45 bis
50 g Chlor aufgenommen worden sind, wozu man etwa 7 bis 8 Stunden
benötigt. Nach dem Erkalten gießt man das Reaktionsgemisch in einen
Scheidetrichter, versetzt mit dem gleichen Volumen (etwa 90 ml)
konzentrierter Schwefelsäure und schüttelt kräftig durch. Beim
Schütteln tritt eine leichte Erwärmung ein. Man lässt absitzen, trennt
sofort die obere Phase ab (beim längeren Stehen kann Kristallisation
eintreten) und destilliert sie über eine kleine Fraktionierkolonne.
Wenn die Schichten schlecht zu erkennen sind, gießt man die
Reaktionsmischung in ein Becherglas und trennt nach dem Erstarren die
flüssige Phase ab.
Die feste Phase wird anschließend destilliert. Dabei geht bis 92 °C ein
farbloser Vorlauf über; zwischen 92 bis 98 °C das Rohchloral (etwa 50
g). Im Kolben bleibt ein dunkel gefärbter Rückstand zurück.
Zur Darstellung des Chloralhydrats werden 46 g Rohchloral in einen
Rundkolben gegeben und langsam aus einer Pipette mit 5.5 ml Wasser
versetzt. Beim Umschütteln setzt die Hydratbildung unter
Wärmeentwicklung ein. Nach dem Abkühlen im Eisbad und Reiben mit einem
Glasstab erfolgt Kristallisation. Man lässt 2 bis 3 Stunden lang im
Eisbad stehen und kristallisiert dann in der Weise um, dass man den
Kristallbrei in der Wärme in etwa 10 ml Chloroform löst. Die Lösung
wird bei 30 bis 40 °C portionsweise mit Petrolether (etwa 200 ml) bis
zur Trübung versetzt und über Nacht im Eisschrank stehen gelassen. Die
ausgefallenen Kristalle werden auf der Nutsche abfiltriert, wobei man
sie mit einem Glasstopfen zusammenpresst und mit etwa 30 ml eiskaltem
Petrolether wäscht. Getrocknet wird im Exsikkator über
Paraffinschnitzel. Die Ausbeute beträgt etwa 35 g, bzw. 14% d. Th.;
Schmp.: 47 bis 49 °C.
Eigenschaften: Farblose,
durchsichtige Kristalle von stechendem Geruch und schwach bitterem,
brennendem Geschmack; leicht löslich in Wasser, Ethanol, Ether,
Glycerin, Chloroform und fetten Ölen.
Therapeutische Verwendung: Das
1832 von Justus von Liebig dargestellte Chloralhydrat wurde 1869 von O.
Liebreich als erstes synthetisches Schlafmittel in die Therapie
eingeführt. Chloralhydrat wird in der üblichen Dosis (1 bis 2 g) rasch
resorbiert; nach 10 bis 15 Minuten tritt die Wirkung ein. Im Organismus
wird es in den narkotisch wirkenden Trichlorethylalkohol übergeführt,
der durch Kupplung mit Glucuronsäure als Urochloralsäure entgiftet
wird. Chloralhydrat ist ein Schlafmittel, dessen Wirkung bis zu 8
Stunden anhält. Nachwirkungen wie Benommenheit und Schwere im Kopf
treten in der Regel nicht auf. Es wirkt aber auf die Schleimhaut des
Magens reizend und wird daher besser mit einem Schleimzusatz (Mucilago
Gummi arabici, Salep-, Tragant- oder Haferschleim) verabfolgt.
Chloralhydrat wird daneben auch zur Behandlung zentraler Krampfzustände
bei Kindern und Erwachsenen verwandt. Größere Dosen, ebenso wie
chronische Verabfolgung schädigen wie Chloroform Herz, Leber und
Nieren. In hohen Dosen wirkt Chloralhydrat negativ inotrop, verkürzt
die Refraktärperiode, verursacht Atemdepression und senkt den
Blutdruck. Die oral toxische Dosis beträgt etwa 10 g. Obwohl die
Bedeutung von Chloralhydrat als Schlafmittel abgenommen hat, war es
1995 noch unter den 2000 meist verordneten Arzneimitteln.
Quelle: Winterfeld, K. - Praktikum der organisch-präparativen
Pharmazeutischen Chemie, 6. Auflage, Steinkopff Verl., 1965 • Schwabe u.
Paffrath - Arzneiverordnungsreport, Stuttgart: Fischer 1995 • Kuschinsky,
Lüllmann, Mohr - Kurzes Lehrbuch der Pharmakologie und Toxikologie,
13. Auflage, Stuttgart: Thieme 1993
Delivered by: Mephisto
Letzte Aktualisierung: 17/05/05
Andere Bezeichnungen: Trichloracetaldehydhydrat; 2,2,2-Trichlor-1,1-ethandiol